1. Kwalifikujący się pacjenci
Leczenie lekami Kaftrio i Kalydeco w ramach programu lekowego B.112. – „Leczenie chorych na mukowiscydozę (ICD-10: E84)” będzie przysługiwać pacjentom od 2 r. ż. z potwierdzonym rozpoznaniem mukowiscydozy, którzy posiadają mutację F508del na przynajmniej jednym allelu.
Inne oznaczenia tej mutacji genu CFTR to:
- ΔF508
- c.1521_1523del
- 1653delCTT
- p.Phe508del
- Phe508del
Informacje o mutacji genu CFTR możesz odnaleźć w dokumentacji medycznej (może znajdować się na wypisie ze szpitala) lub w wyniku badania klicznego (zob. poniżej).
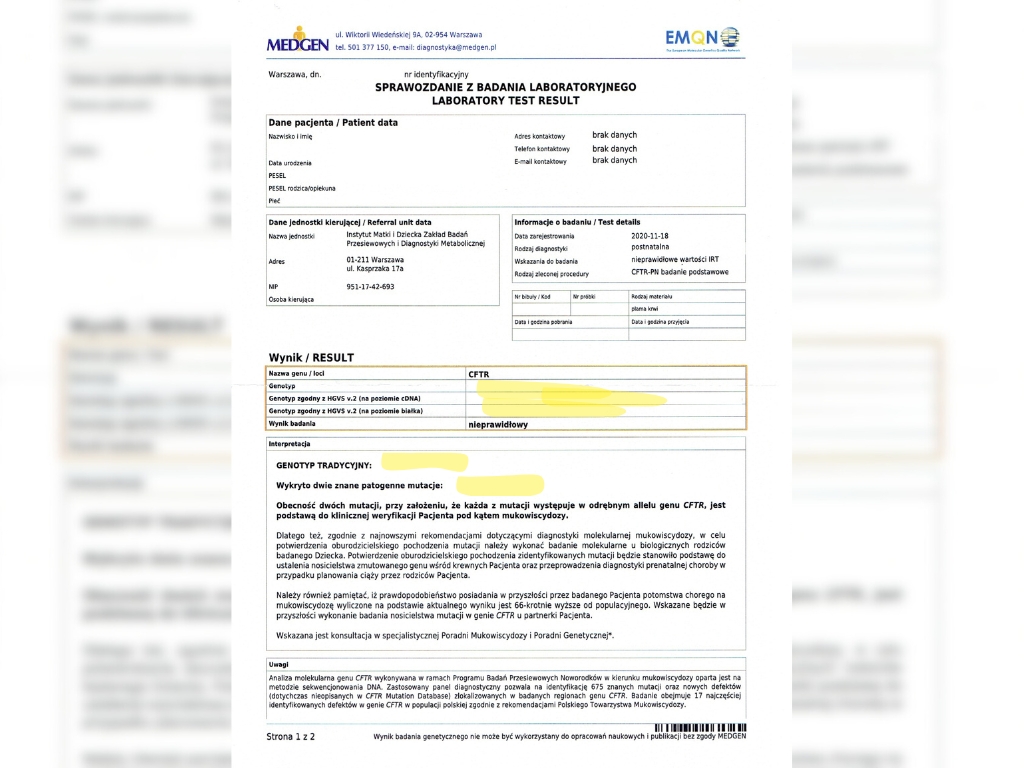 Przykładowy wynik badania genetycznego (zaznaczone fragmenty zawierają informację o mutacji genu CFTR).
Przykładowy wynik badania genetycznego (zaznaczone fragmenty zawierają informację o mutacji genu CFTR).
2. Włączenie do leczenia
Włączenie do programu leczenia mukowiscydozy wymaga spełnienia określonych kryteriów kwalifikacji, które ocenia lekarz prowadzący, doświadczony w leczeniu tej choroby. Lekarze z ośrodków leczenia mukowiscydozy są poinformowani o możliwościach rozszerzenia terapii o nowe, innowacyjne leki. Wdrożenie leczenia będzie wymagało nieco cierpliwości, ponieważ leki te są wydawane w ramach programów lekowych realizowanych w szpitalach, co wiąże się z koniecznością dopełnienia formalności.
| BADANIA KWALIFIKACYJNE DO PROGRAMU LEKOWEGO | ||
|---|---|---|
| # | Nazwa | Na ile wcześniej przed włączeniem do programu lekowego |
| 1 | Test ciążowy (u kobiet w wieku rozrodczym) | do 1 tyg. przed |
| 2 | Badanie kwestionariuszowe w kierunku depresji i lęku (wypełnia opiekun pacjenta do 12 r. ż. lub pacjent samodzielnie od 12 r. ż.) | |
| 3 | Badanie enzymów wątrobowych (z krwi) | do 3 miesięcy przed |
| 4 | Test potowy | |
| 5 | Badanie mikrobiologiczne plwociny lub wymazu z gardła | |
| 6 | Badanie spirometryczne (o ile możliwe) | |
| 7 | Badanie okulistyczne (dzieci do 18 r. ż.) | |
| 8 | Badanie obrazowe klatki piersiowej | do 12 miesięcy przed |
3. Kontrole stanu zdrowia
Pacjenci włączeni do programu lekowego będą musieli być poddani regularnym badaniom kontrolnym, co ma zapewnić bezpieczeństwo stosowania terapii. Rozpocznie się także określanie skuteczności terapii. Leki będą wydawane w szpitalu w regularnych odstępach czasu.
| BADANIA KONTROLNE W PIERWSZYM ROKU UDZIAŁU W PROGRAMIE LEKOWYM | |||||
|---|---|---|---|---|---|
| # | Nazwa | po 12 tyg. (+/- 6 dni) | po 24 tyg. (+/- 6 dni) | po 36 tyg. (+/- 6 dni) | po 48 tyg. (+/- 6 dni) |
| 1 | badanie kwestionariuszowe w kierunku depresji i lęku (wypełnia opiekun pacjenta do 12 r. ż. lub pacjent samodzielnie od 12 r. ż.) | nd. | |||
| 2 | badanie enzymów wątrobowych (z krwi)* | ||||
| 3 | test potowy* | nd. | nd. | ||
| 4 | badanie mikrobiologiczne plwociny lub wymazu z gardła* | ||||
| 5 | badanie spirometryczne (o ile możliwe)* | ||||
|
* Po pierwszych 48 tygodniach leczenia (około rok czasu) powyższe badania (oznaczone gwiazdką), podobnie jak konsultacja okulistyczna, odbywają się raz na 48 tygodni (+/- 14 dni), czyli mniej więcej raz na rok. Podczas każdej wizyty jest także wykonywany pomiar masy i wysokości ciała oraz wskaźnika BMI z oceną wartości centylowych. |
|||||
4. Ocena skuteczności leczenia
Po każdych 48 tygodniach leczenia należy dokonać oceny skuteczności leczenia w odniesieniu do parametrów zmierzonych przed rozpoczęciem leczenia.
Wskaźniki efektywności mierzone po każdych 48 tygodniach leczenia (+/- 14 dni):
- Ocena funkcji płuc na podstawie badań spirometrycznych (o ile możliwe).
- Stężenie jonów chloru w pocie.
- Liczba hospitalizacji.
- Liczba zaostrzeń oskrzelowo-płucnych (leczonych dożylnie antybiotykami).
5. Wyłączenie z programu lekowego
Istnieją także kryteria, dla których pacjent może być wyłączony z programu lekowego, do których należą:
- Brak skuteczności leczenia w ocenie trzyosobowego konsylium lekarskiego.
- Stan po przeszczepieniu płuc.
- Aktywność aminotransferazy alaninowej lub asparaginowej 5-krotnie większa od górnej granicy normy lub 3-krotnie większa od górnej granicy normy z jednoczesnym podwyższeniem stężenia bilirubiny 2-krotnie powyżej górnej granicy normy (po zmniejszeniu i ustabilizowaniu aktywności tych parametrów, można rozważyć powrót do leczenia, bez ponownej kwalifikacji chorego).
- Ciężkie zaburzenia funkcjonowania wątroby.
- Wystąpienie działań niepożądanych uniemożliwiających kontynuację leczenia zgodnie z decyzją lekarza.
- Okres ciąży lub planowania ciąży lub karmienia piersią (wyłączenie czasowe, na okres trwania ciąży, planowania ciąży i karmienia piersią – zalecenie wynika z braku wystarczających danych bezpieczeństwa; stosowanie jest możliwe, o ile lekarz prowadzący i pacjentka wyrażą na to zgodę).
- Wystąpienie objawów nadwrażliwości na którykolwiek ze stosowanych leków lub na którąkolwiek substancję pomocniczą leku, uniemożliwiających kontynuację leczenia.
- Wystąpienie chorób lub stanów, które według oceny lekarza prowadzącego uniemożliwiają dalsze prowadzenie leczenia.
- Wystąpienie nieakceptowalnej lub zagrażającej życiu toksyczności, pomimo zastosowania adekwatnego postępowania.
- Wycofanie zgody na monitorowanie efektów klinicznych leczenia na podstawie danych zebranych przez świadczeniodawcę lub płatnika w systemach informatycznych oraz w polskiej części Europejskiego Rejestru Mukowiscydozy.
- Brak współpracy lub nieprzestrzeganie zaleceń lekarskich, w tym dotyczących okresowych badań kontrolnych oceniających skuteczność i bezpieczeństwo leczenia, ze strony świadczeniobiorcy lub jego opiekuna prawnego.
Pomimo rozszerzenia programu lekowego, warto pamiętać, że w Polsce wciąż istnieje grupa chorych, dla których modulatory CFTR nie są skuteczne. Dla tych pacjentów nie ma jeszcze na świecie dostępnych leków, co oznacza, że nadal będą musieli codziennie wykonywać skomplikowane i czasochłonne zabiegi podtrzymujące życie. Istnieją również osoby po przeszczepach narządów oraz pacjenci, którzy ze względu na swój stan zdrowia lub skutki uboczne nie będą mogli korzystać z nowej terapii. Dla nich sytuacja niestety pozostaje bez zmian.
W związku z tym, konieczne jest dalsze działanie i praca na rzecz rozwoju nowych metod leczenia, które będą w stanie objąć wszystkich pacjentów, niezależnie od ich indywidualnych warunków zdrowotnych. To wyzwanie, które wciąż stoi przed środowiskiem medycznym, organizacjami pacjenckimi i całym społeczeństwem.
