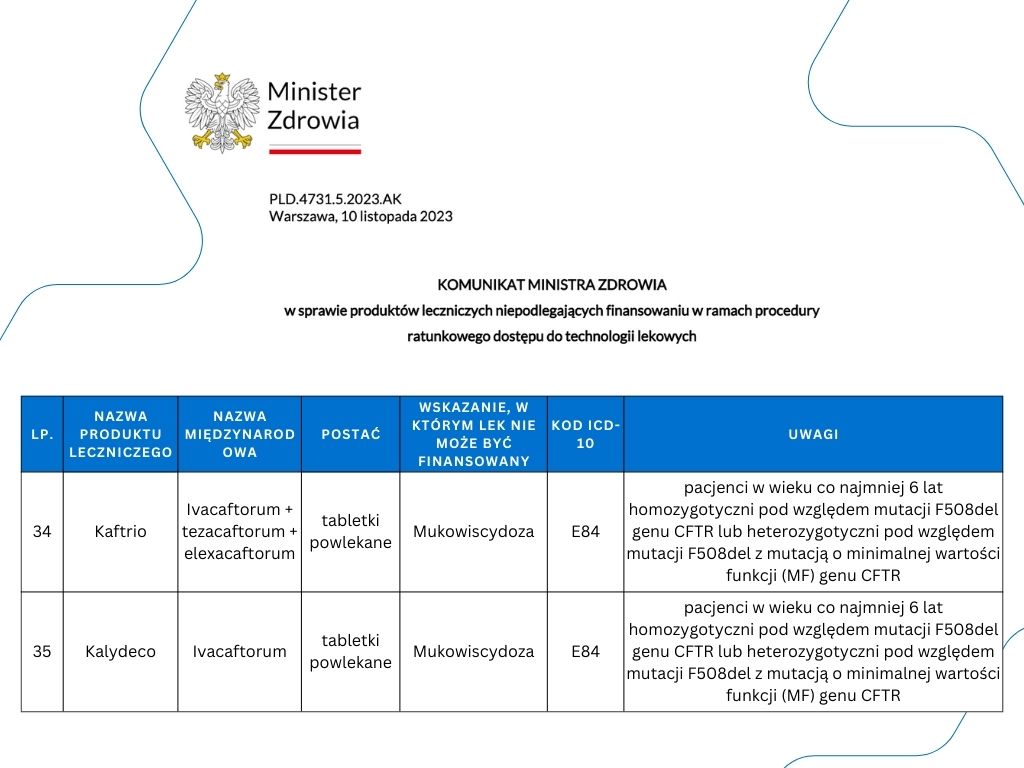
Rzecznik Praw Pacjenta, po zapoznaniu się z pismem Fundacji Mukobohaterowie wystosował pismo do Ministra Zdrowia. W wystąpieniu przytoczona jest argumentacja podjęta przez naszą organizację i prośba o komentarz w tej sprawie. Przypominamy, że 10 listopada 2023 roku Minister Zdrowia opublikował komunikat w sprawie produktów leczniczych niepodlegających finansowaniu w ramach procedury ratunkowego dostępu do technologii lekowych (RDTL). Na liście leków niepodlegających finansowaniu znalazły się leki Kaftrio i Kalydeco (patrz infografika przedstawiająca fragment komunikatu poniżej).
W tej sprawie ustaliliśmy, że Minister Zdrowia nie posiadał opinii prawnych wskazujących na to, że przepisy prawa, na które się powoływał, mogą być stosowane rozszerzająco. W oczywisty sposób nie przesądza to o zgodności lub niezgodności z prawem podjętych działań. Niemniej, w naszej ocenie, świadczy to o zbyt pochopnym podejściu do sprawy dotyczącej ratowania życia ludzkiego.
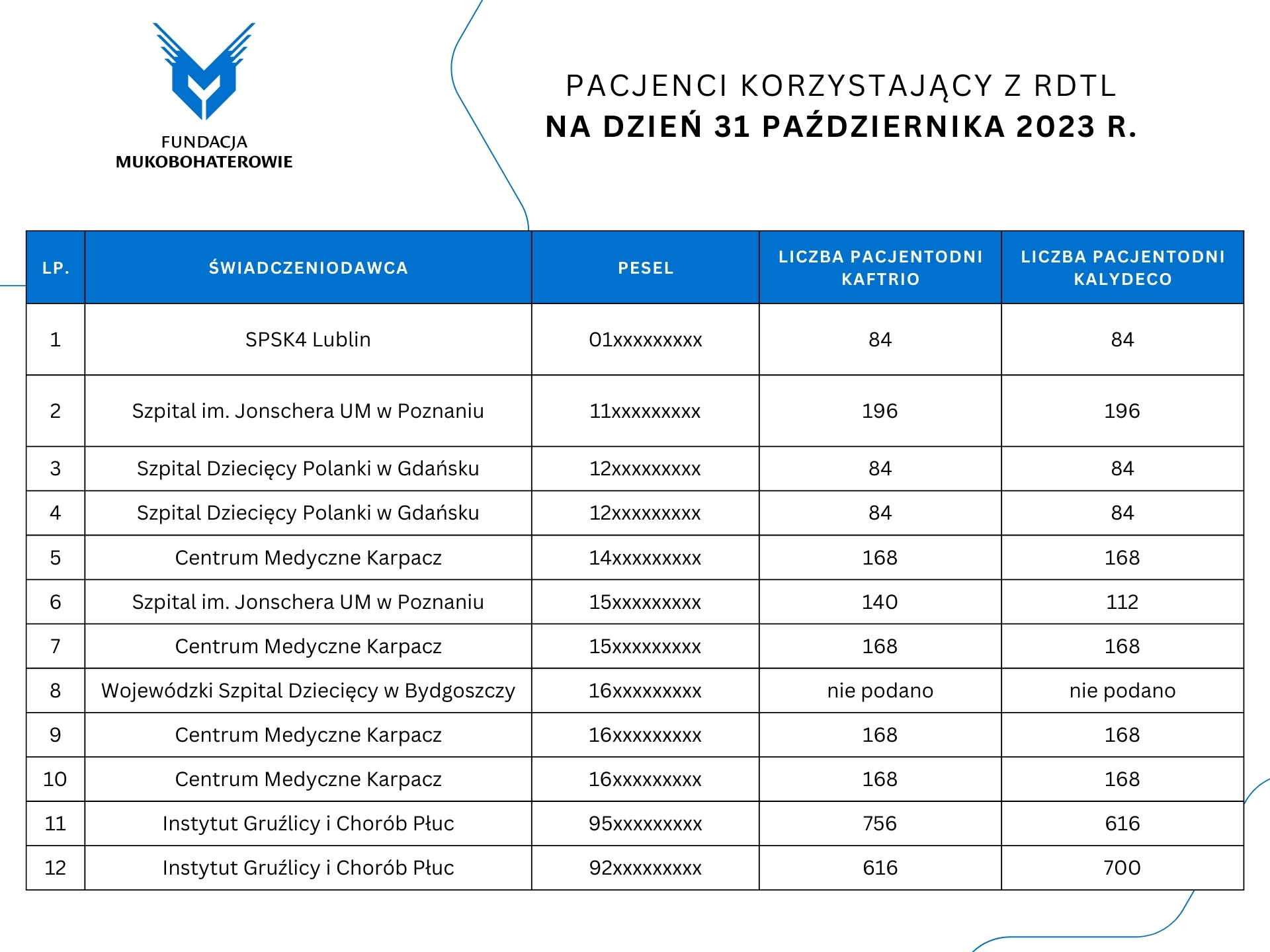
Jednocześnie uzyskaliśmy informację o liczbie pacjentów korzystających dotychczas z terapii w ramach RDTL. Zgodnie z przewidywaniami ten ekstraordynaryjny tryb leczenia został zastosowany do niewielkiej grupy chorych. Lekami Kaftrio i Kalydeco, w ramach przytoczonej procedury, leczonych jest 12 pacjentów. Część z nich to chorzy powyżej 12 roku życia. Zwracamy na to szczególną uwagę, gdyż w opini publicznej pojawiają się informacje o refundacji leków od 12 roku życia, podczas gdy istnieje w tym względzie znaczące ograniczenie w stosunku do rejestracji europejskiej.
Na infografice poniżej zaprezentowaliśmy zanonimowaną listę pacjentów korzystających z RDTL na dzień 31 października 2023 r. według informacji przedstawionych przez Ministerstwo Zdrowia.
Przedstawiamy poniżej pełną treść pism Fundacji Mukobohaterowie, odpowiedzi Ministerstwa Zdrowia na przedłożone wnioski oraz wystąpienie Rzecznika Praw Obywatelskich.





Kliknij na miniaturę, aby otworzyć w nowej karcie
Ratunkowy Dostęp do Technologii Lekowych to mechanizm finansowania szpitalom, ze środków publicznych, kosztów leków dla indywidualnego pacjenta w sytuacji, gdy wykorzystane zostały dostępne refundowane technologie lekowe i okazały się one nieskuteczne dla ratowania jego życia lub zdrowia.
Obecnie znanych jest ponad 2000 mutacji genu oznaczonego jako CFTR, z czego około 700 skutkujących wystąpieniem mukowiscydozy. Mukowiscydoza jest ciężką chorobą wielonarządową, spowodowaną wadą obu alleli CFTR. Spora liczba mutacji choroby powoduje dużą różnorodność w populacji pacjentów, w konsekwencji utrudnia badania kliniczne i dzieli pacjentów na podgrupy i dedykowane im leczenie.
Leki Kaftrio i Kalydeco (kosztujące pacjenta komercyjnie nawet 80 tys. złotych miesięcznie) są refundowane w Polsce od marca 2022 roku dla grupy docelowej około 1 tys. z 2 tys. chorych na mukowiscydozę. W Polsce terapia jest dostępna dla chorych powyżej 12 roku życia z konkretnymi mutacjami choroby.
Według aktualnie obowiązującego programu lekowego, finansowanie ze środków publicznych jest dostępne dla chorych spełniających łącznie dwie przesłanki (poza kryterium wieku i szeregiem innych wytycznych dotyczących stanu zdrowia): posiadających przynajmniej jedną mutację F508del (najczęściej występująca) i drugą mutację selektywnie określoną tzw. minimalnej wartości funkcji (zgodnie z wcześniej prowadzonymi badaniami klinicznymi). Po pewnym czasie skuteczność i bezpieczeństwo leków stwierdzono dla chorych powyżej 6 roku życia (nie jak dotychczas 12 lat – a zatem chorych znacznie młodszych) i dla większej liczby mutacji mukowiscydozy (wystarczy, aby chory miał przynajmniej jedną mutację F508del, a to dotyczy ok. 81% chorych w Europie). Przyznały to agencje dopuszczające leki na rynek amerykański (FDA) i europejski (EMA). Wprowadzenie leczenia dla nowych grup pacjentów wymaga rozpatrzenia nowego wniosku refundacyjnego. Ten został złożony przez firmę Vertex Pharmaceuticals (Poland) Sp. z o.o. 31 maja 2022 roku, ale po długotrwałych negocjacjach podmiot wycofał go. Podczas trwania procesu administracyjnego Prezes Agencji Oceny Technologii Medycznych i Taryfikacji (dalej Prezes AOTMiT) wydał Rekomendację nr 113/2022 z 28 listopada 2022 r. Rekomendacja stanowiła, że „Prezes Agencji rekomenduje objęcie refundacją produktów leczniczych (…) pod warunkiem pogłębienia instrumentu dzielenia ryzyka oraz zaproponowania dodatkowego instrumentu dzielenia ryzyka zabezpieczającego całkowity wpływ na budżet płatnika.”.
