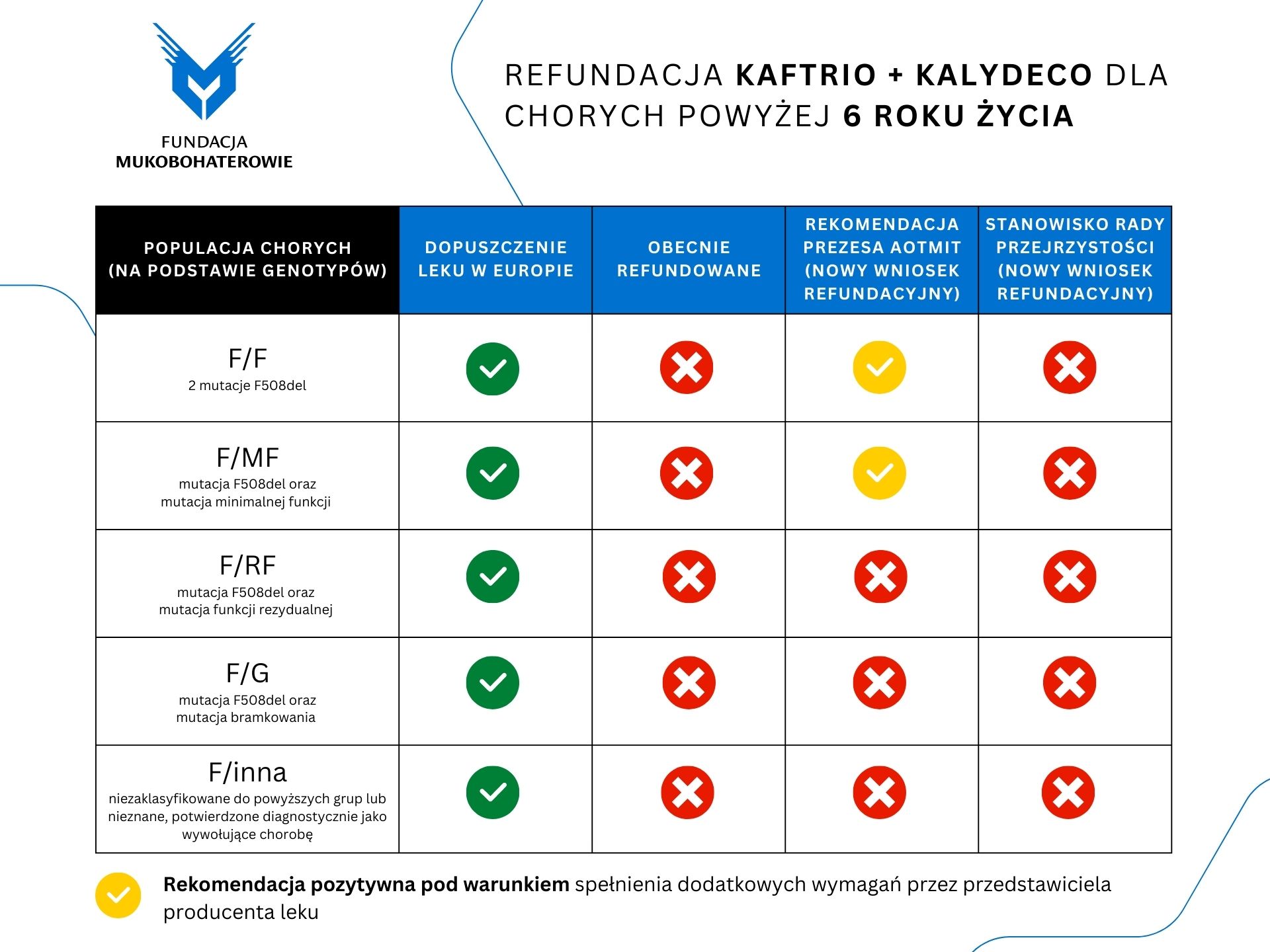
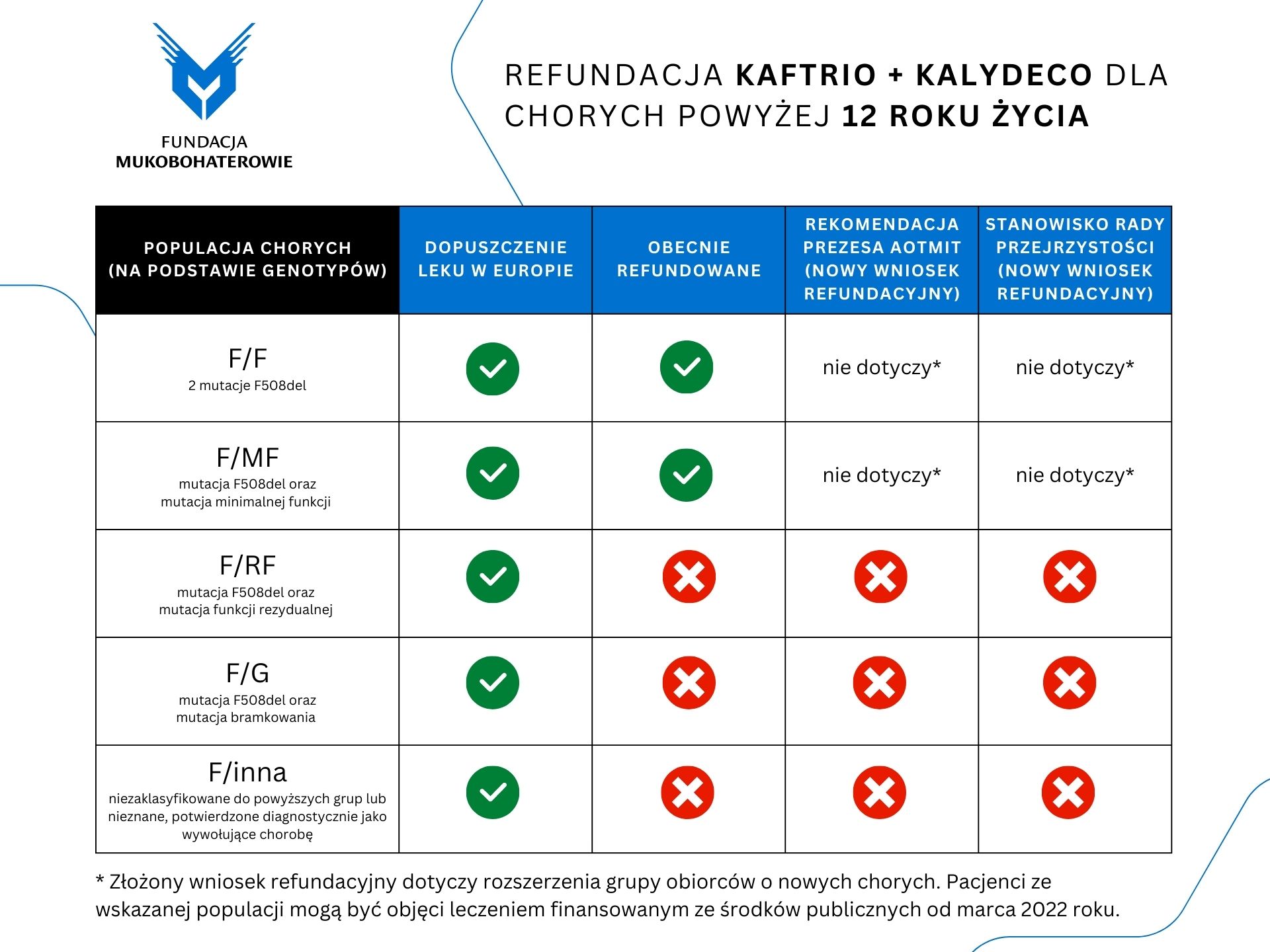
Po wielu tygodniach oczekiwania zostały upublicznione decyzje Rady Przejrzystości i Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji. Na grafikach poniżej przedstawiamy konsekwencje decyzji dla poszczególnych grup wiekowych i genotypów chorego. Dalej przedstawiamy skrót poruszanych tematów oraz na samym końcu pełne stanowisko Fundacji Mukobohaterowie (kliknij na grafikę na dole strony, aby otworzyć dokument PDF).
Z niedowierzaniem przyjęliśmy rekomendację Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji (AOTMiT) dotyczącą ograniczenia grupy odbiorców we wnioskowanej refundacji drogimi lekami Kaftrio i Kalydeco dla chorych na mukowiscydozę powyżej 6 roku życia oraz negatywne stanowisko Rady Przejrzystości dotyczące rozszerzenia leczenia na nowe grupy pacjentów. Nasz stanowczy sprzeciw budzi argumentacja podnoszona w uzasadnieniu stanowiska drugiej jednostki.
- Dwa pierwsze główne argumenty stanowiska Rady dotyczą przesłanek kosztowych, w zupełności nie odnoszą się do kwestii społecznych i etycznych (dla części chorych rozpatrywane leczenie, kosztujące komercyjnie pacjenta nawet 80 tys. złotych miesięcznie, jest jedyną terapią przyczynową o udowodnionej efektywności klinicznej; mamy do czynienia z lekami ratującymi życie, z medianą zgonu pacjentów w wieku zaledwie 24 lat),
- Opis problemu decyzyjnego stworzony przez Radę, jak i treść ostatniego z głównych argumentów stanowiska (mówiący jedynie o rozszerzeniu refundacji dla kolejnej grupy wiekowej, podczas gdy chodzi także o rozszerzenie dostępności terapii dla chorych z kolejną grupą genotypów) rodzi pytanie, na podstawie jakich przesłanek zostało podjęte stanowisko Rady. W stanowisku są przedstawione alternatywne metody leczenia, które mogą stwarzać wrażenie, że każdy pacjent otrzymuje lub otrzyma (po osiągnięciu odpowiedniego wieku) leczenie przyczynowe. Negatywna decyzja Ministra idąca za tym stanowiskiem całkowicie wykluczyłaby pacjentów z pewnymi genotypami choroby z leczenia przyczynowego, a część z nich pozostawiła z mniej skutecznym, choć wciąż bardzo kosztownym dla budżetu leczeniem,
- Wśród głównych argumentów decyzji Rady pojawia się teza o znaczeniu braku badań klinicznych dotyczących przeżycia i odsetka transplantacji płuc, podczas gdy analitycy Agencji w analizie weryfikacyjnej (AWA - dokument, na podstawie którego Rada wydawała stanowisko) przedstawili szereg wyników, które wskazują na poprawę krytycznych, istotnych klinicznie parametrów. Dodatkowo, w podsumowaniach najważniejszych wyników analiz klinicznych, wyjaśniali FEV1, liczbę zaostrzeń płucnych, BMI, masę ciała, wskaźnik z-score masy ciała dla wieku, jako niezależne predyktory śmiertelności lub przeżywalności.
- Ostatni z głównych argumentów Rady podnosi brak argumentów naukowych wskazujących na konieczność zmiany negatywnego stanowiska dla terapii lekami Kaftrio i Kalydeco z czerwca 2021 roku (dla innej grupy docelowej). Faktem jest upublicznienie po tym czasie kolejnych badań, w tym takich, które pokazały korzyści długotrwałego i wczesnego leczenia lekami oraz m.in. analizy danych z amerykańskiego rejestru pacjentów z mukowiscydozą, która wskazuje na zmniejszenie ryzyka przeszczepienia płuc (operacja ratująca życie) u chorych o 87 proc. i ryzyka zgonu o 74 proc. w porównaniu z historycznymi danymi. Być może te informacje stały się podstawą pozytywnej opinii Rady Przejrzystości z sierpnia 2021 dotyczącej umieszczenia wspomnianej terapii w wykazie technologii lekowych o wysokiej wartości klinicznej. Terapia została także refundowana dla części pacjentów przez Ministra Zdrowia w marcu 2022 roku.
- Niezrozumiała jest rekomendacja Prezesa AOTMiT dotycząca grupy pacjentów powyżej 12 roku życia (brak rozszerzenia grupy odbiorców terapii). W swoim stanowisku Prezes krótko ocenia jakość dowodów naukowych dotyczących grup pacjentów F/RF oraz F/G. Pragniemy zwrócić uwagę, że jedno z ocenianych badań charakteryzowało się bardzo dobrą jakością (wnioski analityków wykonujących AWA), pokazywało poprawę w kontekście szeregu ważnych lub krytycznych punktów końcowych i chociaż trwało krótko, to ocena utrzymywania się efektu terapii jest prowadzona jako kontynuacja fazy wydłużonej badania bez zaślepienia. Poprzednie badania typu OLE, dla innych populacji (z podobnym efektem zdrowotnym pacjentów), wykazywały oczekiwany efekt.
- Obie decyzje nie odzwierciedlają w pełni specyfiki chorób rzadkich, w szczególności tych jednostek chorobowych, które powodują podział pacjentów na subpopulacje. Istnieją grupy chorych, które mogłyby odnieść korzyści z leczenia, ale są one nieliczne lub wciąż niescharakteryzowane. To stwarza znane ograniczenia dla prowadzenia badań klinicznych dla leków sierocych. W przypadku niektórych mutacji skuteczność leczenia była potwierdzona badaniami charakteryzującymi się mniejszą pewnością. Mówimy jednak o lekach ratujących życie i obecnie jedynej szansie na dłuższe przeżycie pacjentów. Niektóre państwa rozumiejąc tę specyfikę dopuszczają do leczenia tą terapią szersze grupy chorych, bazując na badaniach typu in-vitro: jak chociażby w USA zgodnie z rejestracją FDA lub w Anglii poprzez rozszerzenie dostępu do leczenia off-label.
- Warto podkreślić, że sami analitycy Agencji w swoim komentarzu określają, że „Pomimo różnorodności analiz, biorąc pod uwagę grupy wiekowe, genotypy i komparatory, wyniki są spójne, wzajemnie się uzupełniają i potwierdzają, że efekt trójlekowej modulacji F508del-CFTR jest na tyle duży, że wystarcza obecność tylko pojedynczej mutacji F508del by osiągnąć oczekiwaną korzyść kliniczną.” (podkreślenie własne). Co więcej, sugerowali, że rozszerzenie leczenia dla całej wnioskowanej populacji pacjentów jest „w pełni uzasadnione” (podkreślenie własne).
Przedstawiamy poniżej pełną treść stanowiska Fundacji Mukobohaterowie, Rady Przejrzystości oraz rekomendacji Prezesa AOTMiT.



Kliknij na miniaturę, aby otworzyć w nowej karcie
Obecnie znanych jest ponad 2000 mutacji genu oznaczonego jako CFTR, z czego około 400 skutkujących wystąpieniem mukowiscydozy. Mukowiscydoza jest ciężką chorobą wielonarządową, spowodowaną wadą obu alleli CFTR. Spora liczba mutacji choroby powoduje dużą różnorodność w populacji pacjentów, w konsekwencji utrudnia badania kliniczne i dzieli pacjentów na podgrupy i dedykowane im leczenie.
Leki Kaftrio i Kalydeco (kosztujące pacjenta komercyjnie nawet 80 tys. złotych miesięcznie) są refundowane w Polsce od marca 2022 roku dla grupy docelowej około 1 tys. z 2 tys. chorych na mukowiscydozę. W Polsce terapia jest dostępna dla chorych powyżej 12 roku życia z konkretnymi mutacjami choroby.
Według aktualnie obowiązującego programu lekowego, finansowanie ze środków publicznych jest dostępne dla chorych spełniających łącznie dwie przesłanki (poza kryterium wieku i szeregiem innych wytycznych dotyczących stanu zdrowia): posiadających przynajmniej jedną mutację F508del (najczęściej występująca) i drugą mutację selektywnie określoną (zgodnie z wcześniej prowadzonymi badaniami klinicznymi). Po pewnym czasie skuteczność i bezpieczeństwo leków stwierdzono dla chorych powyżej 6 roku życia (a więc chorych znacznie młodszych) i dla większej liczby mutacji mukowiscydozy (wystarczy, aby chory miał przynajmniej jedną mutację F508del, a to dotyczy ok. 81% chorych w Europie). Przyznały to agencje dopuszczające leki na rynek amerykański (FDA) i europejski (EMA). Wprowadzenie leczenia dla nowych grup pacjentów wymaga rozpatrzenia nowego wniosku refundacyjnego, a ten został złożony przez firmę Vertex Pharmaceuticals 31 maja 2022 roku. Stanowisko Rady Przejrzystości i rekomendacja Prezesa AOTMiT, to jedne z ostatnich kroków przed decyzją refundacyjną Ministra Zdrowia. Obecnie negocjacje cenowe będzie prowadziła Komisja Ekonomiczna. Następnie należy spodziewać się decyzji administracyjnej szefa resortu zdrowia.