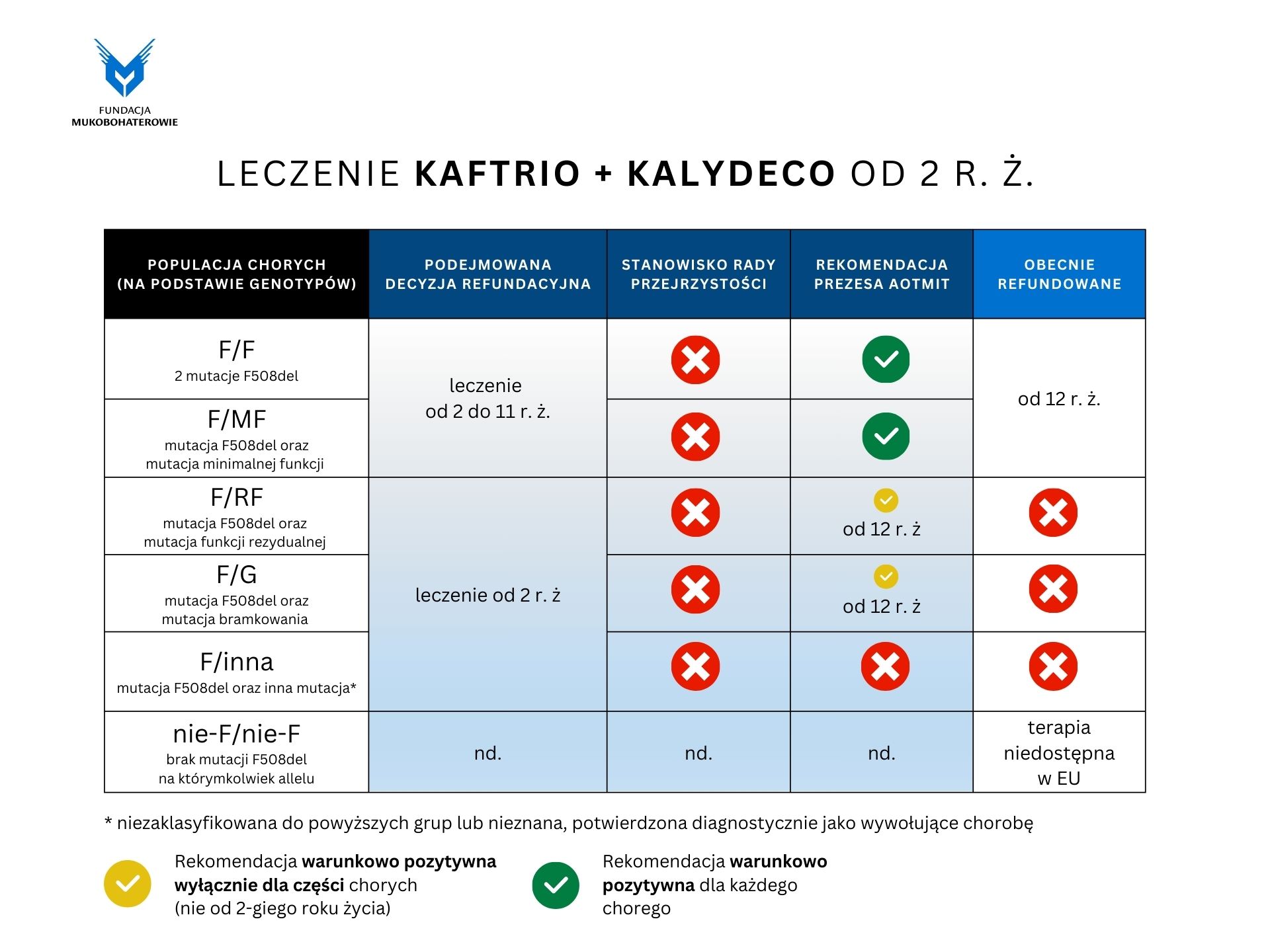
W ostatnich dniach zostały upublicznione decyzje Rady Przejrzystości i Prezesa Agencji Oceny Technologii Medycznych i Taryfikacji. Na grafikach poniżej przedstawiamy rekomendacje dla poszczególnych grup wiekowych i genotypów chorego. Dalej przedstawiamy skrót poruszanych tematów oraz na samym końcu pełne stanowisko Fundacji Mukobohaterowie (kliknij na grafikę na dole strony, aby otworzyć dokument PDF).
- Mamy głęboką nadzieję, że określony przez Prezesa Agencji Technologii Medycznych i Taryfikacji warunek zaproponowania przez firmę Vertex Pharmaceuticals akceptowalnych warunków finansowych (nie mniej korzystnych dla płatnika publicznego niż obecnie obowiązujące w pokrewnych problemach decyzyjnych) dla rekomendowanego rozszerzenia programu lekowego to wyłącznie formalność.
- Apelujemy zarówno do firmy farmaceutycznej, jak i do Ministerstwa Zdrowia o porozumienie pozwalające na refundację produktów leczniczych zgodnie ze złożonym wnioskiem tj. szerzej niż zaproponowano w rekomendacji, w sposób tożsamy z rejestracją terapii w UE, a zatem dodatkowo (w stosunku do obecnej refundacji) dla pacjentów:
- w wieku od ukończonego 2. r. ż. do ukończenia 12. z mutacją typu F/x
- w wieku od ukończonego 12. r. ż. z mutacją typu F/x, inną niż F/MF lub F/F
- Ufamy, że ograniczenia ściśle związane ze specyfiką chorób rzadkich tj. małe subpopulacje pacjentów (w szczególności związane ze znacznie rzadziej występującymi w populacji genotypami tj. F/RF, F/G, F/inna; pogłębiane dodatkowo przyporządkowaniem pacjentów do dwóch kolejnych, mniejszościowych grup wiekowych tj. 2-5 lat oraz 6-11 lat), trudności z badaniami klinicznymi na dzieciach (w tym brak możliwości wykonania niektórych badań ze względu na umiejętności psychofizyczne pacjenta) nie staną się powodem do przyjęcia założeń odmiennych od tych wyrażonych w stanowisku EMA (daleko idąca ekstrapolacja danych)
- Ekstrapolując wyniki analiz ze starszej populacji chorych z mutacją typu F/RF lub F/G na młodszą populację należy zauważyć, że obecna rekomendacja pozostawiałaby grupę tych pacjentów z przewidywalnie znacznie mniej skutecznym leczeniem na długie lata (odpowiednio przez 6 i 10 lat).
- Ważna jest problematyka subpopulacji dla których przedmiotowe leczenie jest pierwszą terapią przyczynową, która może wykazać znaczącą poprawę leczenia względem SoC (istnieje niezaspokojona potrzeba zdrowotna). Jest to szczególnie istotne dla chorych na mukowiscydozę z mutacją typu F/inna od 2 r. ż., ale także dla pacjentów z mutacją typu F/RF od 2 r. ż. do 5 r. ż. Wystąpienie u chorego na mukowiscydozę najczęściej występującej w populacji mutacji F508del na jednym z alleli i spodziewana korzyść kliniczna wynikająca już z tego faktu (bez względu na wystąpienie drugiej, rzadkiej mutacji, dla której trudno spodziewać się badań klinicznych) może stanowić dla pacjentów z mutacją typu F/inna jedyną szansę na leczenie
- Apelujemy do Ministerstwa Zdrowia i firmy Vertex Pharmaceuticals, aby dodatkowo oba podmioty wzięły odpowiedzialność za podkreślone przez nas wyzwania i nie uznały, że akceptowalną konsekwencją wyższego ryzyka leczenia pewnych grup pacjentów ma być wykluczenie ich z możliwości dłuższego i jakościowo lepszego życia. Promujemy podejście, aby instrumenty dzielenia ryzyka adekwatnie racjonalizowały leczenie wszystkich pacjentów.
- W dyskusji o innowacyjnych lekach przytaczamy informacje z analizy danych z amerykańskiego rejestru pacjentów z mukowiscydozą (dotyczy grupy ponad 16 tys. amerykańskich chorych). Wskazują one na zmniejszenie ryzyka przeszczepienia płuc (operacja ratująca życie) u chorych o 87 proc. i ryzyka zgonu o 74 proc. w porównaniu z historycznymi danymi.
Przedstawiamy poniżej pełną treść stanowiska Fundacji Mukobohaterowie oraz rekomendacji Prezesa AOTMiT.


Kliknij na miniaturę, aby otworzyć w nowej karcie
Obecnie znanych jest ponad 2000 mutacji genu oznaczonego jako CFTR, z czego około 1000 skutkujących wystąpieniem mukowiscydozy. Mukowiscydoza jest ciężką chorobą wielonarządową, spowodowaną wadą obu alleli CFTR. Spora liczba mutacji choroby powoduje dużą różnorodność w populacji pacjentów, w konsekwencji utrudnia badania kliniczne i dzieli pacjentów na podgrupy i dedykowane im leczenie.
Leki Kaftrio i Kalydeco (kosztujące pacjenta komercyjnie nawet 80 tys. złotych miesięcznie) są refundowane w Polsce od marca 2022 roku dla grupy docelowej około 1 tys. z 2 tys. chorych na mukowiscydozę. W Polsce terapia jest dostępna dla chorych powyżej 12 roku życia z konkretnymi mutacjami choroby.
Według aktualnie obowiązującego programu lekowego, finansowanie terapii ze środków publicznych jest dostępne dla chorych spełniających łącznie dwie przesłanki (poza kryterium wieku i szeregiem innych wytycznych dotyczących stanu zdrowia): posiadających przynajmniej jedną mutację F508del (najczęściej występująca) i drugą mutację selektywnie określoną (zgodnie z wcześniej prowadzonymi badaniami klinicznymi). Po pewnym czasie skuteczność i bezpieczeństwo leków stwierdzono dla chorych powyżej 2 roku życia (a więc chorych znacznie młodszych) i dla większej liczby mutacji mukowiscydozy (wystarczy, aby chory miał przynajmniej jedną mutację F508del, a to dotyczy ok. 85% chorych w Polsce). Przyznały to agencje dopuszczające leki na rynek amerykański (FDA) i europejski (EMA). Wprowadzenie leczenia dla nowych grup pacjentów wymaga rozpatrzenia nowego wniosku refundacyjnego, a ten został złożony przez firmę Vertex Pharmaceuticals 23 kwietnia 2024 roku. Stanowisko Rady Przejrzystości i rekomendacja Prezesa AOTMiT, to jedne z ostatnich kroków przed decyzją refundacyjną Ministra Zdrowia. Obecnie negocjacje cenowe będzie prowadziła Komisja Ekonomiczna. Następnie należy spodziewać się decyzji administracyjnej szefa resortu zdrowia.